La terapia farmacologica nei pazienti pediatrici
Farmacocinetica: neonati ed infanti
Assorbimento
Distribuzione
Metabolismo epatico
Escrezione renale
Farmacocinetica: bambini da 1 anno in avanti
Reazioni avverse ai farmaci
Determinazione del dosaggio
Promuovere l’aderenza
I pazienti molto giovani o molto anziani rispondono ai farmaci diversamente dal resto della popolazione. La maggior parte delle differenze sono quantitative. Cioè, i pazienti di entrambi i gruppi sono più sensibili ai farmaci rispetto agli altri pazienti, e mostrano una maggiore variabilità individuale. La sensibilità farmacologica nei soggetti molto giovani dipende largamente dall’immaturità dei sistemi d’organo. La sensibilità farmacologica negli anziani dipende largamente dalla degenerazione dei sistemi d’organo. A causa della elevata sensibilità farmacologica, i pazienti di entrambi i gruppi d’età corrono un aumentato rischio di reazioni avverse ai farmaci. In questo articolo discuteremo i fattori fisiologici che sono alla base della elevata sensibilità farmacologica nei pazienti pediatrici, così come le vie per promuovere un uso sicuro ed efficace dei farmaci.
La pediatria copre tutti i pazienti al di sotto dei 16 anni. A causa della crescita e dello sviluppo in corso, i pazienti pediatrici nei diversi gruppi d’età presentano differenti problemi terapeutici. Tradizionalmente, la popolazione pediatrica si divide in sei gruppi:
- Neonati prematuri (meno di 36 settimana di gravidanza)
- Neonati a termine (da 36 a 40 settimane di gravidanza)
- Neonati (prime 4 settimane di vita)
- Infanti (dalla 5a alla 52a settimana di vita)
- Bambini (da 1 a 12 anni)
- Adolescenti (da 12 a 16 anni)
Non sorprendentemente, mano a mano che i giovani pazienti crescono, diventano sempre più fisiologicamente simili agli adulti, e quindi sempre più simili agli adulti riguardo alla terapia farmacologica. Al contrario, i molto giovani – quelli con meno di 1 anno, e soprattutto quelli con meno di 1 mese d’età – sono molto diversi dagli adulti. Se la terapia farmacologica in questi pazienti deve essere sicura ed efficace, dobbiamo tener conto di queste differenze.
La terapia farmacologica pediatrica è resa ancora più difficoltosa dalle insufficienti informazioni sui farmaci. Fino a poco tempo fa, La Food and Drug Administration (FDA) poteva non richiedere studi farmacologici nei bambini. Di conseguenza, su molti farmaci dati a giovani pazienti, non abbiamo buone informazioni su dosi, farmacocinetica ed effetti, sia terapeutici che avversi. Nonostante la mancanza di informazioni utili, dobbiamo usare comunque farmaci per trattare pazienti pediatrici. Quindi, similmente a ciò che avviene nella terapia durante la gravidanza, i clinici devono provare ad equilibrare benefici e rischi senza conoscere con precisione quali sono realmente i benefici ed i rischi.
FARMACOCINETICA: NEONATI ED INFANTI
I fattori farmacocinetici determinano la concentrazione di un farmaco nei suoi siti d’azione, e quindi determinano l’intensità e la durata delle risposte. Se i livelli di farmaco sono elevati, le risposte saranno più intense. Se l’eliminazione del farmaco è ritardata, le risposte si prolungheranno. Poiché i sistemi d’organo che regolano i livelli farmacologici non si sono completamente sviluppati nei molto giovani, questi pazienti sono a rischio per entrambe le possibilità: gli effetti farmacologici sono insolitamente intensi e prolungati. Tenendo conto delle differenze farmacocinetiche nei molto giovani, possiamo aumentare le possibilità che la terapia farmacologica sia efficace e sicura.
La figura 1 illustra quanto i livelli farmacologici differiscono tra infanti ed adulti in seguito alla somministrazione di dosi equivalenti (per es., dosi aggiustate in relazione al peso corporeo). Quando un farmaco viene somministrato per via endovenosa (Fig. 1A), i livelli declinano più lentamente nell’infante rispetto all’adulto. Di conseguenza, i livelli farmacologici nell’infante rimangono al di sopra della concentrazione minima efficace (MEC) per un tempo più lungo che nell’adulto, e quindi causano un prolungamento dell’effetto. Quando un farmaco è somministrato per via sottocutanea (Fig. 1B), non solo i livelli nell’infante rimangono al di sopra della MEC più a lungo che nell’adulto, ma questi livelli sono anche più alti, determinando un effetto più intenso e più prolungato. Da queste figure, è chiaro che l’aggiustamento della dose per gli infanti sulla base solo delle dimensioni corporee non è sufficiente per ottenere risultati sicuri.

Figura 1. Paragone dei livelli farmacologici plasmatici negli adulti e negli infanti.
A, livelli farmacologici plasmatici dopo iniezione IV. Il dosaggio è stato aggiustato per peso corporeo. Si noti che i livelli plasmatici rimangono al di sopra della concentrazione minima efficace (MEC) molto più a lungo nell’infante. B, livelli farmacologici plasmatici dopo iniezione subQ. Il dosaggio è stato aggiustato per peso corporeo. Si noti che sia il livello farmacologico massimo che la durata dell’azione sono più grandi nell’infante.
Se le piccole dimensioni corporee non sono il motivo principale per l’innalzamento della sensibilità farmacologica negli infanti, allora quale è? L’aumentata sensibilità degli infanti è largamente dovuta allo stato immaturo di cinque processi farmacocinetici: (1) assorbimento del farmaco, (2) legame dei farmaci alle proteine, (3) esclusione dei farmaci dal sistema nervoso centrale (CNS) grazie alla barriera emato-encefalica, (4) metabolismo epatico dei farmaci, e (5) escrezione renale dei farmaci.
Assorbimento
Somministrazione orale. La fisiologia gastrointestinale nell’infante è molto diversa da quella dell’adulto. Di conseguenza, l’assorbimento dei farmaci può essere aumentato o impedito, in dipendenza delle proprietà fisico-chimiche del farmaco coinvolto.
Il tempo di svuotamento gastrico è sia prolungato che irregolare nella prima infanzia, e quindi raggiunge gradualmente i valori dell’adulto dai 6 agli 8 mesi. Per i farmaci che vengono assorbiti principalmente nello stomaco, il ritardato svuotamento gastrico aumenta l’assorbimento. Dall’altro lato, per i farmaci che vengono assorbiti principalmente nell’intestino, l’assorbimento è ritardato. A causa del fatto che il tempo di svuotamento gastrico è irregolare, l’impatto preciso sull’assorbimento non è prevedibile.
L’acidità gastrica è molto bassa 24 ore dopo la nascita e non raggiunge i valori dell’adulto per i primi due anni. A causa della bassa acidità, l’assorbimento di farmaci poco acidi è aumentata.
Somministrazione intramuscolare. L’assorbimento dei farmaci dopo iniezione IM nel neonato è lento e fallace. Il ritardato assorbimento è dovuto in parte al basso flusso sanguigno attraverso i muscoli durante i primi giorni di vita post-natale. Nella prima infanzia, l’assorbimento IM dei farmaci diviene più rapido rispetto ai neonati ed agli adulti.
Assorbimento percutaneo. A causa del fatto che la cute dei molto giovani è sottile, l’assorbimento percutaneo dei farmaci è significativamente maggiore che nei bambini più grandi e negli adulti. Ciò aumenta il rischio di tossicità dei farmaci topici.
Distribuzione
Legame alle proteine. Nell’infante il legame dei farmaci all’albumina e ad altre proteine plasmatiche è limitato. Perché? Perché (1) la quantità di albumina è relativamente bassa e (2) composti endogeni (per es., acidi grassi, bilirubina) competono con i farmaci per i siti di legame disponibili. Di conseguenza, farmaci che ordinariamente vanno incontro ad un esteso legame proteico negli adulti, si legano molto meno negli infanti. Come risultato, nell’infante la concentrazione dei livelli liberi di tali farmaci è relativamente alta, e quindi gli effetti si intensificano. Per assicurare che gli effetti non siano troppo intensi, i dosaggi negli infanti dovrebbero essere ridotti. La capacità di legame alle proteine raggiunge i valori adulti entro i 10-12 mesi.
Barriera emato-encefalica. La barriera emato-encefalica non è pienamente sviluppata alla nascita. Di conseguenza, farmaci ed altre sostanze chimiche hanno un accesso relativamente facile al SNC, rendendo l’infante particolarmente sensibile ai farmaci che influenzano la funzione del SNC. Quindi, tutte le medicine impiegate per i loro effetti sul SNC (per es., morfina, fenobarbital) dovrebbero essere somministrate in dosaggi ridotti. Il dosaggio dovrebbe essere ridotto anche per farmaci usati per azioni al di fuori del SNC se questi farmaci sono in grado di produrre tossicità al SNC come effetto collaterale.
Metabolismo Epatico
La capacità di metabolizzazione dei farmaci nei neonati è bassa. Di conseguenza, i neonati sono particolarmente sensibili ai farmaci che sono principalmente eliminati attraverso il metabolismo epatico. Quando questi farmaci vengono utilizzati, il dosaggio va ridotto. La capacità del fegato di metabolizzare molti farmaci aumenta rapidamente 1 mese circa dopo la nascita, e si avvicina ai livelli dell’adulto pochi mesi dopo. La completa maturazione del fegato avviene entro 1 anno.
La capacità minima di metabolizzazione dei farmaci da parte del neonato è illustrata dai dati della tabella I. Questi dati derivano da esperimenti sul metabolismo e sugli effetti dell’esobarbital (un depressore del SNC) in animali neonati ed adulti. Il metabolismo era misurato in preparazioni di enzimi microsomiali di fegato di porcellini d’India. L’effetto dell’esobarbital – depressione del SNC – veniva valutato nei topi. La durata del sonno in seguito ad iniezione di esobarbital era usata come indice della depressione del SNC.
Come indicato nella tabella I, la capacità di metabolizzazione dei farmaci del fegato adulto è molto più grande rispetto alla capacità di metabolizzare i farmaci del fegato neonato. Mentre la preparazione di fegato adulto ha metabolizzato in media il 33% di esobarbital somministrato, virtualmente non c’era metabolizzazione misurabile con la preparazione dei neonati.
L’impatto fisiologico della limitata capacità di metabolizzare i farmaci è indicata dalla durata del sonno osservata nei neonati contro la durata del sonno negli adulti dopo iniezione di esobarbital. Come si vede nella tabella I, una bassa dose (10 mg/kg) di esobarbital ha determinato una durata del sonno di meno di 5 minuti. Al contrario, la stessa dose ha causato una durata del sonno di 6 ore nei neonati. Gli effetti diversi negli adulti e nei neonati sono molto più drammatici a dosi più elevate (50 mg/kg): Mentre gli adulti dormivano appena 20 minuti, questa dose era letale per i neonati.
Escrezione Renale
L’escrezione renale dei farmaci è significativamente ridotta alla nascita. Il flusso sanguigno renale, la filtrazione glomerulare, e la secrezione tubulare attiva sono tutte basse durante l’infanzia. Poiché negli infanti la capacità di escrezione dei farmaci è limitata, i farmaci che sono eliminati principalmente con l’escrezione renale devono essere somministrati a dosaggio ridotto. Livelli adulti di funzione renale si raggiungono intorno ad 1 anno.
La relativa incapacità del rene dell’infante all’escrezione di composti estranei è illustrata dai dati della tabella 2. Questi mostrano il tasso di escrezione renale di due composti: inulina e acido para-amminoippurico (PAH). L’inulina è escreta interamente attraverso filtrazione glomerulare. PAH è escreta sia attraverso filtrazione glomerulare che secrezione tubulare attiva. Si noti che l’emivita dell’inulina è di 630 minuti negli infanti ma solo di 120 minuti negli adulti. Dal momento che l’inulina è eliminata solo per filtrazione glomerulare, questi dati dicono che il ritmo di filtrazione glomerulare nell’infante è molto più lento che nell’adulto. Dai dati della clearance di PAH, insieme ai dati di clearance dell’inulina, possiamo concludere che anche la secrezione tubulare negli infanti è molto più lenta che negli adulti. 
FARMACOCINETICA: BAMBINI DI 1 ANNO ED OLTRE
All’incirca verso l’età di 1 anno, molti parametri farmacocinetici nei bambini sono simili a quelli degli adulti. Quindi, la sensibilità farmacologica nei bambini con più di 1 anno è più simile a quella degli adulti che non a quella dei più giovani. Nonostante siano farmacocineticamente simili agli adulti, i bambini ne differiscono per una importante caratteristica: metabolizzano i farmaci più velocemente degli adulti. La capacità di metabolizzare i farmaci è marcatamente elevata fino all’età di 2 anni, e poi declina gradualmente. Un ulteriore rapido declino si ha alla pubertà, quando vengono raggiunti i valori degli adulti. A causa dell’aumentato metabolismo dei farmaci nei bambini, un aumento della dose o una riduzione dell’intervallo tra le dosi potrebbe essere necessario per farmaci che sono eliminati dopo metabolismo epatico.
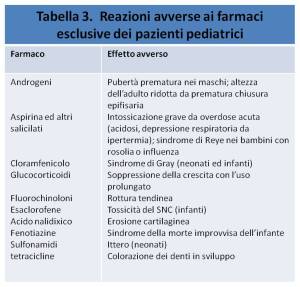
REAZIONI AVVERSE AI FARMACI
Come gli adulti, i pazienti pediatrici sono soggetti a reazioni avverse quando i livelli dei farmaci si innalzano troppo. Oltre a queste reazioni correlate alla dose, i pazienti pediatrici sono vulnerabili verso reazioni avverse uniche correlate allo stato immaturo dei sistemi d’organo ed alla crescita e allo sviluppo in corso. Tra questi effetti correlati all’età ci sono la soppressione della crescita (causata dai glucocorticoidi), la colorazione dei denti in sviluppo (causata dalle tetracicline), e l’ittero (causato dai sulfamidici). La tabella 3 presenta un elenco di farmaci che possono causare effetti avversi specifici nei pazienti pediatrici a varie età. Dovrebbe essere attuata una cura particolare per evitare la somministrazione di questi farmaci in pazienti resi vulnerabili dall’età.
DETERMINAZIONE DEL DOSAGGIO
A causa dei fattori farmacocinetici discussi prima, la selezione del dosaggio per i pazienti pediatrici è difficile. Selezionare un dosaggio è particolarmente difficile nei molto giovani, dal momento che i fattori farmacocinetici stanno andando incontro a cambiamenti rapidi.
Le dosi pediatriche sono state stabilite per alcuni farmaci ma non per altri. Per i farmaci per cui non sono state stabilite dosi pediatriche, il dosaggio può essere estrapolato dalle dosi dell’adulto. Il metodo di conversione impiegato più comunemente si basa sull’area della superficie corporea:
Area della superficie corporea del bambino x dose dell’adulto
dose approssimativa per il bambino = _________________________________________________
1,73 m2
Si deve notare che le dosi pediatriche iniziali – indipendentemente se basate su dosi pediatriche già stabilite o estrapolate dalla dose dell’adulto – sono nel migliore dei casi un’approssimazione. Le dosi successive devono essere aggiustate sulla base del risultato clinico e delle concentrazioni plasmatiche del farmaco. Questi aggiustamenti sono importanti soprattutto nel neonato e nell’infante più piccolo. Chiaramente, se l’aggiustamento del dosaggio deve essere ottimale, è essenziale monitorare il paziente per le risposte terapeutiche ed avverse.
PROMUOVERE L’ADERENZA
Ottenere la somministrazione di dosaggi accurati e con la giusta tempistica richiede la partecipazione informata dei genitori del bambino o del tutor e, nei limiti del possibile, anche il coinvolgimento del bambino. Una istruzione efficace è critica. Si dovrebbero affrontare i seguenti argomenti:
- Entità e tempistica del dosaggio
- Via e tecnica di somministrazione
- Durata del trattamento
- Conservazione del farmaco
- La natura e la cinetica delle risposte desiderate
- La natura e la cinetica delle risposte avverse
Dovrebbero essere fornite delle istruzioni scritte. Per tecniche di somministrazione difficili, dovrebbe essere fatta una dimostrazione, dopo la quale i genitori dovrebbero ripetere la procedura per assicurarsi della comprensione della stessa. Con bambini piccoli, sversamenti e perdite sono cause frequenti di dosaggio inaccurato; i genitori dovrebbero stimare la quantità di farmaco persa e risomministrare una quantità uguale, facendo attenzione a non eccedere. Quando è più di una persona ad occuparsi del bambino, tutti i partecipanti dovrebbero essere avvertiti del pericolo di somministrazioni multiple. Molteplici somministrazioni dovrebbero essere evitate grazie alla compilazione di un foglio di somministrazione dei farmaci. In alcuni disordini – soprattutto le infezioni – i sintomi potrebbero risolversi prima del completamento del corso di trattamento prescritto. I genitori dovrebbero essere istruiti a completare il trattamento pieno nonostante ciò. Altre vie per promuovere l’aderenza sono (1) selezionare la forma e la posologia di dosaggio più conveniente, (2) suggerire di mischiare i farmaci orali con cibo o succhi (se è possibile) per migliorarne il sapore, (3) fornire un cucchiaio calibrato per medicine o una siringa per misurare le formulazioni liquide, e (4) avere pazienza con i bambini o genitori svantaggiati per aiutarli ad assicurare una partecipazione cosciente e competente.
Punti Chiave
▪ A causa dell’immaturità dei sistemi d’organo, i pazienti molto giovani sono altamente sensibili ai farmaci.
▪ Nei neonati e nei bambini piccoli, le risposte farmacologiche possono essere inusualmente intense e prolungate.
▪ L’assorbimento di farmaci per via IM nei neonati è più lento che negli adulti. Al contrario l’assorbimento di farmaci IM negli infanti è più rapido che negli adulti.
▪ La capacità di legame alle proteine è limitata nei primi periodi di vita. Quindi, le concentrazioni libere di alcuni farmaci potrebbero essere particolarmente elevate.
▪ La barriera emato-encefalica non è sviluppata in modo completo alla nascita. Quindi, i neonati sono particolarmente sensibili ai farmaci che influenzano il SNC.
▪ La capacità di metabolizzare i farmaci dei neonati è bassa. Quindi, i neonati sono particolarmente sensibili ai farmaci che sono eliminati principalmente attraverso il metabolismo epatico.
▪ L’escrezione renale dei farmaci è bassa nei neonati. Quindi, i farmaci che sono eliminati principalmente dal rene devono essere dati a dosaggio ridotto.
▪ Nei bambini di 1 anno ed oltre, molti parametri farmacocinetici sono simili a quelli degli adulti. Quindi, la sensibilità ai farmaci è più simile a quella degli adulti che a quella dei bambini più piccoli.
▪ I bambini (da 1 a 12 anni) farmacocineticamente differiscono dagli adulti in quanto metabolizzano i farmaci più rapidamente.
▪ Le dosi pediatriche iniziali sono nel migliore dei casi un’approssimazione. Quindi, le dosi successive devono essere aggiustate sulla base del risultato clinico e dei livelli plasmatici del farmaco.
(Tratto da Richard A. Lehne, “PHARMACOLOGY for nursing care”, Sixth edition, Saubders Elsevier, 2007)

Leave a comment