Disordini genetici da morte cellulare programmata nel sistema immune
Riassunto
La genetica umana offre nuove possibilità per capire i meccanismi regolatori fisiologici ed i disordini del sistema immune. Le anormalità genetiche dei programmi di morte cellulare dei linfociti hanno fornito approfondimenti dei meccanismi di biologia dei recettori e dei principi di omeostasi e tolleranza immunitaria. A questo punto, ci sono due malattie principali da morte cellulare programmata con mutazioni umane ereditarie: la sindrome linfoproliferativa autoimmune e lo stato da deficienza di caspasi-8. Noi descriviamo i dettagli della loro patogenesi molecolare e discutiamo come queste malattie illustrino importanti concetti della regolazione immune e della genetica.
INTRODUZIONE
La genetica umana ha fatto il proprio ingresso in una nuova era. Gli avanzamenti tecnologici consentono ai ricercatori di studiare le malattie ereditarie con una precisione molecolare mai vista prima e quindi di chiarire le normali vie fisiologiche. Il sequenziamento completo del DNA del genoma umano, nuove tecniche per introdurre DNA all’interno di cellule primarie e cellule trasformate, e l’interferenza ad RNA per inibire selettivamente l’espressione genica consentono ora ai ricercatori di esaminare le cellule umane in modo così potente come con cellule da organismi di modelli sperimentali. Il vantaggio principale della ricerca sull’uomo è sempre stato l’apprezzamento vasto e la documentazione di condizioni genetiche insolite. Il matrimonio tra nuove tecnologie e ricerca sulle malattie porta al proscenio l’uomo e forse fa dei sistemi sperimentali animali delle comparse nella ricerca genetica futura.
Come il sistema immune mantiene l’omeostasi e la tolleranza rimane un problema di importanza fondamentale. Da un lato, ne deriva deplezione linfocitaria ed immunodeficienza. Dall’altro lato, il fallimento dei meccanismi regolatori può causare una sovrabbondanza di linfociti fino ad un possibile cancro, così come reazioni autoimmuni ed allergiche. La sindrome autoimmune linfoproliferativa (ALPS) è uno dei primi disordini ereditari dell’apoptosi ad essere stato descritto. La ricerca su questa malattia ha portato alle prime descrizioni di mutazioni ereditarie in geni che codificano proteine caspasiche nell’uomo. E’ chiaro che deficienze nel recettore di morte Fas/APO-1/CD95, nel Fas ligando (fasL o CD95L), nella caspasi-8, e caspasi-10 influenzano principalmente il sistema immune. Infatti, è stato difficile trovare anormalità in qualsiasi altro sistema d’organo associate con mutazioni di questi geni nell’uomo. In questo contesto, queste mutazioni rivelano il ruolo centrale dell’apoptosi nell’omeostasi immune. Lavori recenti mettono in evidenza anche un ruolo chiave per queste molecole ed una forma aggiuntiva di morte non apoptotica nella regolazione immune (N. Bidere & M. Lenardo, osservazioni non pubblicate). Una osservazione chiave è che nell’ALPS predominano mutazioni dominanti negative dei geni che codificano fattori di morte. Questo tipo di mutazione predomina perché la trasduzione di un segnale di morte coinvolge specifici complessi stechiometrici di proteine che sono suscettibili di interferenza per l’inclusione in essi di componenti mutanti di segnale. Dato l’ampio coinvolgimento di complessi proteici non covalenti nei processi cellulari, è probabile che l’interferenza dominante sia un modo comune di anormalità genetica in persone, che tipicamente non siano consanguinei. Quindi, i meccanismi della malattia dovuti a mutazioni eterozigotiche possono essere maggiormente preminenti rispetto a quelle attribuibili a mutazioni omozigotiche. Infine, un altro avanzamento concettuale che origina da queste malattie è che la sovrabbondanza di linfociti non significa necessariamente un aumento di funzione. La deficienza di caspasi-8 causa, per esempio, linfocitosi dovuta ad alterata apoptosi insieme ad immunodeficienza da difettoso segnale del recettore per l’antigene.
La regolazione immune da parte della morte cellulare programmata
Una visione semplificata della regolazione linfocitaria da parte dell’apoptosi è utile per ragionare sui meccanismi molecolari coinvolti (figura 1). I principi di base delle vie di morte intrinseca (da mancanza di linfochine) ed estrinseca (recettori di morte) sono state riassunte precedentemente. Nella loro essenza, l’assunzione di elevate quantità di antigene stimola la via estrinseca di morte come mezzo per limitare la risposta immune e prevenire immunotossicità. Dall’altro lato, l’eliminazione degli antigeni determina una diminuita produzione di citochine trofiche e di morte cellulare nella via intrinseca. Questo evento libera l’organismo dall’eccesso di linfociti non necessari e ripristina l’omeostasi. L’analisi genetica nei topi mostra che uno squilibrio di qualsiasi delle due vie può portare ad una perdita nel controllo dei linfociti e della tolleranza. Cellule specifiche per l’antigene che evadono entrambe le vie e ritornano ad uno stato di riposo contribuiscono al pool di cellule della memoria. Il pool della memoria può essere successivamente chiamato in causa per risposte anamnestiche. Il concetto chiave è che i linfociti T e B maturi possono essere programmati a morire in maniera antigene-specifica. Questa morte cellulare controllata dall’antigene sostiene il controllo dinamico sia del numero cellulare dei linfociti sia della tolleranza immunologica nel sistema immune periferico. Poiché variazioni nei livelli antigenici stimolano le cellule T ad uccidere o loro stessi o le cellule B, ciò costituisce una via di morte autoregolatoria o propriocida. Recentemente, è stato proposto che una linea individuale di cellule T regolatorie possano assumere funzioni soppressive nelle risposte immuni. Noi ed altri abbiamo osservato che gli effetti soppressivi di queste cellule sono dovuti all’induzione della morte cellulare nei loro bersagli. Tuttavia, è stato fatto poco per esaminare le possibili funzioni di protezione immune dalla morte indotta da questo tipo di cellule. Quindi, è difficile sapere se gli effetti soppressivi contribuiscono alla tolleranza propria attraverso la delezione o effetti di attesa di una risposta immune che coinvolga l’uccisione cellulare.
Nonostante inizialmente si pensasse che la via estrinseca causasse apoptosi mediata da recettori di morte della superfamiglia di recettori del fattore di necrosi tumorale (TNF), dati successivi hanno rivelato una situazione più complessa. La stimolazione antigenica delle cellule T causa l’induzione di FasL e di TNF, che possono innescare i corrispondenti recettori che contengono il dominio di morte (death domain – DD). Inoltre, la stimolazione del FasL sulle cellule T può indurre la morte dei linfociti B che sono state attivate ed esprimono Fas (figura 1). La necessità della stimolazione antigenica per provocare la via – anche se spesso confusa con un mezzo per rimuovere i linfociti al termine di una risposta immune – indica la propria importanza per l’autoregolazione negativa durante una risposta proliferativa dei linfociti all’antigene. Una complessità è rappresentata dal fatto che il blocco dei recettori di morte non elimina completamente la capacità della stimolazione del recettore per l’antigene di uccidere le cellule T. Ciò suggerisce che esistono meccanismi alternativi di morte che non sono stati ancora chiaramente identificati. Un secondo livello di complessità è che il blocco dell’apoptosi indotto da Fas non previene la morte. Infatti, l’aggiunta dell’inibitore pan-caspasico zVAD alla stimolazione di Fas porta all’aumento di una morte cellulare alternativa in cellule T umane attivate del sangue periferico. Ci sono state molte osservazioni che la stimolazione sia del Fas che del recettore I per il TNF (TNFR1) possano portare a programmi di necrosi. Presumibilmente, ciò fornisce un’importante alternativa nei casi in cui virus ed altri agenti infettivi siano in grado di impedire l’apoptosi. Tuttavia, una più profonda comprensione di questa complessità sarà un obiettivo importante di lavoro in questa area.

Figura 1. La via di morte propriocida nei linfociti. La stimolazione antigenica dei linfociti T in riposo porta alla loro attivazione e proliferazione. Le cellule T attivate esprimono Fas ed il suo specifico ligando, FasL, che regola le cellule B e le APC che esprimono Fas. Effetti simili possono essere mediati da altri recettori di morte. Quando le cellule T incontrano di nuovo alti livelli di antigene, viene innescata la via estrinseca di morte cellulare (apoptosi attiva). Dopo la fine della produzione di antigeni e citochine, diviene operativa l’apoptosi passiva attraverso la via intrinseca. Le cellule T rimanenti costituiscono la popolazione della memoria.
Approfondimenti genetici sulla morte programmata dovuta a Fas
L’eliminazione fisiologica delle cellule T attivate durante una risposta immune può avvenire attraverso una via estrinseca innescata dal coinvolgimento di recettori transmembrana specializzati chiamati recettori di morte. Questi recettori di morte appartengono alla superfamiglia del TNFR ed includono Fas (anche chiamato CD95, TNFRSF6, o APO-1), TNFR1 (anche noto come p60 o TNFRSF1A), recettore di morte 3 (anche conosciuto come DR3 o TNFRSF25) recettore di morte 4 [conosciuto anche come DR4, TNF-related apoptosis-inducing ligand receptor 1 (TRAIL-R1), o TNFRSF10A], recettore di morte 5 (DR5, o TRAIL-R2 o TNFRSF10B), e recettore di morte 6 (DR6 o TNFRSF21). La superfamiglia TNFR è caratterizzata da gruppi da due a cinque domini extracellulari ricchi in cisteina (CRD). I membri del sottogruppo dei recettori di morte del TNFR condividono una regione di 80 amminoacidi moderatamente conservata nella porzione citoplasmatica denominata il dominio di morte (DD), in quanto è necessaria per il segnale di morte. Fas, il recettore di morte prototipico, gioca un ruolo critico nella regolazione linfocitaria da parte della morte apoptotica e, potenzialmente, anche di quella non apoptotica. Fas è attivato da proprio affine ligando, FasL, una proteina transmembrana di tipo 2 che può essere rilasciata in forma solubile da metalloproteinasi. L’espressione sia del ligando che del recettore può essere potentemente aumentata dalla stimolazione antigenica delle cellule T, soprattutto se le cellule sono attivate e coltivate in interleuchina(IL)-2. La stimolazione delle cellule B può indurre i recettori di morte ed il TNFα, ma non l’espressione di FasL. Piuttosto, sembra che le cellule B possano essere uccise attraverso l’adesione a cellule T che esprimono FasL (figura 1).
La maniera fondamentale di segnale da parte dei recettori di morte è la formazione di complessi proteici a due livelli. Primo, è stimolata l’accumulazione del recettore da parte del ligando a formare complessi stechiometrici con proteine di segnale citoplasmatiche. Secondo, un ordine più elevato di aggregati di recettori, ligandi, e proteine di segnale seguono immediatamente e sono cruciali per la trasmissione del segnale. Come esempio, riassumiamo il segnale da Fas. Entro pochi secondi dopo la stimolazione da parte del FasL, Fas recluta la molecola adattatrice FADD e le caspasi iniziatrici caspasi-8 e -10 con la formazione di un grande complesso denominato complesso di segnale che induce la morte (DISC). La formazione del DISC è cruciale per generare attività caspasica ed iniziare il processo apoptotico. Sia Fas che FasL operano come omotrimeri. La loro interazione stimola cambiamenti della conformazione e/o dell’orientamento del trimero recettoriale che consente l’interazione omotipica tra i DD di Fas e di FADD. Oltre al proprio DD all’estremità COOH, FADD possiede anche un dominio di interazione proteina-proteina di circa 80 residui all’estremità NH2 terminale chiamato il dominio effettore di morte (DED), che si trova anche nelle caspasi iniziatrici (o apicali) -8 e -10. E’ rimarchevole che sia DD che DED siano entrambi fasci a sei eliche con un topologia complessiva simile che è condivisa anche dal dominio di reclutamento delle caspasi (CARD). Quindi, questi domini sono forse specializzazioni da un comune antenato. E’ comunque una regola generale, tuttavia, che ciascun dominio interagisca in maniera omotipica, per es., DD con DD, ma non si leghino in maniera crociata l’uno all’altro (DD con DED, etc.). Quindi, come illustrato nella figura 2, FADD è portato nel DISC dalla associazione del proprio DD con quello di Fas e poi recluta nel complesso caspasi-8 e caspasi-10 attraverso l’interazione dei rispettivi DED.
All’interno di questo multi-aggregato proteico, l’aumentata concentrazione locale dei zimogeni caspasi-8/10 promuove presumibilmente un’alterata conformazione che porta alla loro auto-modificazione ed attivazione. Caspasi-8 e -10 contengono entrambe tre parti: un dominio che presenta un doppio DED, una grande subunità enzimatica, ed una piccola subunità enzimatica. Ciascuna di queste parti è fiancheggiata da residui di aspartato che formano i siti di taglio delle caspasi sensibili soprattutto alla loro stessa attività. Inizialmente, si pensava che l’auto-modificazione ed il rilascio delle due subunità enzimatiche fosse essenziale per il segnale di morte. Tuttavia, dati recenti hanno suggerito che le caspasi apicali possano, in certe condizioni, trasmettere il segnale senza essere tagliate ma facendo affidamento solo sulla dimerizzazione o altri aggiustamenti dei monomeri inattivi non modificati. Nonostante ciò, la modificazione delle caspasi apicali stabilizza l’attività catalitica come etero-tetrameri (composti da due subunità piccole e due subunità grandi) e ne consente il rilascio nel citosol. Le caspasi rilasciate, altamente attive, tagliano molteplici bersagli a valle, tra cui caspasi effettrici che iniziano un circuito di amplificazione delle caspasi che porterà alla morte della cellula. Nelle cosidette cellule di tipo I, che includono timociti e cellule T periferiche, è generata una elevata quantità di caspasi-8/10 nel DISC che attiva direttamente caspasi effettrici quali, ad es., la caspasi-3, -6, e -7. Al contrario, in cellule di tipo II, che includono linee cellulari tumorali come Jurkat e CEM, il DISC è più debole, e l’attivazione delle caspasi avviene più lentamente e quindi in minore quantità rispetto alle cellule di tipo I. Nelle cellule di tipo II, un’apoptosi robusta si ottiene grazie all’azione della caspasi-8 su Bid, un membro BH3 proapoptotico della famiglia Bcl-2. La forma tronca attiva di Bid causa il rilascio di citocromo c dai mitocondri e l’attivazione della via intrinseca dell’apoptosi. A causa del coinvolgimento mitocondriale, la morte mediata da recettori di morte in cellule di tipo II, ma non in cellule di tipo I, può essere inibita da membri anti-apoptotici della famiglia Bcl-2.
La formazione del DISC è seguita dalla formazione di aggregati di Fas designati recentemente come strutture di trasduzione del segnale da oligomerizzazione proteica (SPOTS). SPOTS sono composti forse da migliaia di complessi di singoli recettori (che li rendono visibili microscopicamente) che aumentano ulteriormente la concentrazione locale di caspasi-8 e promuovono la propria auto-modificazione ed attivazione. Questa oligomerizzazione recettoriale dipende dal DD del Fas e dal FADD ma non necessita di attività caspasica. Una volta che gli SPOTS sono formati, una ulteriore aggregazione e raggruppamento dipendente dalle caspasi di complessi Fas è seguita dall’internalizzazione del recettore in vescicole che legano marcatori endosomiali. Non è chiaro se l’internalizzazione diminuisce la morte indotta da Fas o se sia un passaggio critico per il segnale di morte, come è stato recentemente dimostrato per i recettosomi TNF. In alternativa, dal momento che l’internalizzazione di Fas dipende dall’attivazione caspasica, può essere un evento post-letale che può anche non avere nessun ruolo regolatorio.
Un regolatore di Fas a livello del DISC potenziamente importante è la proteina cellulare inibitoria di FLICE (c-FLIP) che è presente in due isoforme: c-FLIPSa e c-FLIPL. La proteina c-FLIPL è molto simile a caspasi-8 e -10, ed i geni per tutti e tre si trovano in un aggregato genico nel cromosoma 2q33-34; questa osservazione suggerisce che i geni possano essere derivati da duplicazioni tandem di un gene ancestrale. Nonostante che sia intatto in c-FLIPL un doppio DED, la parte del gene che codifica per le subunità enzimatiche contiene numerose mutazioni che prevengono l’attività caspasica. c-FLIPS è strutturalmente vicino alla controparte virale, v-FLIP, che consiste solamente di un doppio DED ed una breve aggiunta alla terminazione COOH. Sia c-FLIPL che c-FLIPS possono essere reclutati nel DISC, dove tipicamente esercitano un effetto inibitorio sull’attivazione di caspasi-8 e sulla morte cellulare. E’ stato osservato che c-FLIPL ha funzioni diverse e talvolta contraddittorie. Nel DISC c-FLIPL è modificato da caspasi-8 ma non può modificare caspasi-8 in risposta, cosicchè quest’ultimo viene mantenuto in forma non tagliata a livello recettoriale. La stimolazione del recettore delle cellule B può indurre l’espressione di c-FLIPL e bloccare l’uccisione mediata da Fas e TRAIL; questa osservazione indica un suo ruolo potenziale nella selezione e nella tolleranza delle cellule B. D’altro canto, piccole quantità di c-FLIPL possono causare attivazione di caspasi-8 e morte cellulare ed è stato anche proposto che possa promuovere la proliferazione linfocitaria indotta da Fas.

Figura 2. Caspasi-8 è reclutata nella membrana plasmatica ed integra due diversi complessi di segnale, con due differenti conseguenze. Come descritto nel testo, Fas stimola la formazione del DISC con il rilascio nel citosol di caspasi-8 modificata, altamente attiva, che porta alla morte della cellula. Al contrario, la stimolazione del recettore per l’antigene stimola la formazione del signalosoma indotto dall’attivazione del recettore (ARIS). In questo caso, la caspasi-8 attiva rimane non modificata e consente il reclutamento del complesso IkB chinasi (IKK) che promuove l’attivazione di NF-kB.
LA SINDROME AUTOIMMUNE LINFOPROLIFERATIVA (ALPS)
Presentazione clinica
ALPS è un raro disordine umano definito da linfoproliferazione, espansione periferica di cellule T doppie negative αβ (DNT), ed apoptosi linfocitaria alterata. Si osservano anche malattia autoimmune ed un aumentato rischio di linfoma. La presentazione clinica di ALPS nell’uomo, che è stata riassunta eccellentemente in precedenti rassegne, riflette l’alterata omeostasi linfocitaria, particolarmente delle cellule DNT. I criteri diagnostici sono elencati nella tabella 1. La linfoproliferazione apparentemente risulta dal graduale accumulo di linfociti che non sono andati incontro ad una morte programmata cellulare normale. Questa proliferazione porta ad un ingrandimento cronico di linfonodi, timo, fegato, e/o milza, che comincia nella prima infanzia. Sono elevate sia le cellule B, incluse le cellule B CD5+, che le cellule T. Non sono influenzate tutte le sottopopolazioni linfocitarie, dal momento che i numeri assoluti di CD4+CD25+ sono ridotti e i numeri assoluti di CD4+CD25– non sono aumentati. Al contrario, è spiccata l’espansione di una popolazione insolita di cellule T periferiche CD4–CD8–. Queste cellule DNT periferiche esprimono le catene αβ del recettore delle cellule T (TCR) così come l’isoforma B220 del CD45R (tipicamente espresso dalle cellule B); questa espressione le distingue dalle cellule T periferiche ϒδ, che mancano naturalmente dei co-recettori CD4 e CD8. Le DNT differiscono anche dai timociti doppio-negativi, uno stadio immaturo delle cellule T in cui i geni TCR non sono stati ancora arrangiati completamente. Le cellule DNT potrebbero essere o cellule T mature, precedentemente attivate, o una speciale linea cellulare minore. Nel sangue, le cellule DNT costituiscono meno dell’1% in individui normali, ma possono raggiungere fino al 40% in pazienti con ALPS. L’espansione DNT è evidente anche istologicamente per anormalità quasi patognomoniche dell’architettura dei tessuti linfoidi secondari, con iperplasia paracorticale e follicolare.
Sembra che le cellule DNT giochino un ruolo cruciale nello sviluppo della malattia. In alcuni pazienti ALPS che mancano di mutazioni germinali nel recettore di morte Fas, Holzelova et al. hanno trovato una popolazione di cellule DNT che presenta mutazioni somatiche di Fas che interferiscono in maniera dominante. Quindi, cellule DNT non regolate ed eccessive sono evidentemente sufficienti a causare la malattia. Due caratteristiche delle cellule DNT descritte precedentemente ci possono spiegare come. Primo, le cellule DNT sono i produttori principali dell’IL-10 fortemente elevata che si osserva in pazienti ALPS. Al contrario, cellule DNT da individui normali non producono IL-10. Inoltre, parenti sani di pazienti ALPS che presentano sia mutazioni Fas che difetti apoptotici in vitro hanno solo un modesto innalzamento di DNT e IL-10. Accanto all’aumento di IL-10, i pazienti ALPS manifestano anche un aumento di IL-4 e IL-5, ma una diminuzione di IL-2 e IFN-ϒ. Questo profilo citochinico è caratteristico delle cellule T helper di tipo 2 (Th2), che inibiscono l’immunità cellulo-mediata e promuovono le risposte immunitarie umorali. Quindi, l’ambiente citochinico complessivo può favorire la produzione di autoanticorpi nell’ALPS. Secondo, le cellule DNT manifestano un fenotipo insolito che comprende l’espressione di B220 e alterazione degli O-glicani della superficie cellulare. Questo fenotipo potrebbe cambiare il quadro del traffico e/o le potenziali interazioni delle cellule DNT con altri tipi cellulari. Ci sono alcuni importanti ed irrisolti paradossi che riguardano le DNT. Primo, è molto difficile coltivarle in vitro e quasi subito muoiono nonostante un’apparente resistenza all’apoptosi in vivo. La lunghezza della loro vita non è aumentata dall’IL-10. Secondo, nonostante si pensi che le DNT giochino un ruolo nelle risposte immuni iperattive, sono generalmente insensibili a stimoli proliferativi ed attivanti. Infine, le specificità antigeniche riconosciute dai TCR sulle DNT non sono state identificate, ma si assume generalmente che queste includano autoantigeni.
In ALPS la linfoproliferazione è accompagnata da autoimmunità. La maggioranza dei pazienti hanno livelli di immunoglobuline seriche ed autoanticorpi elevati. Sono frequenti anticorpi anti-cardiolipina anche se non sono di solito associati a malattia trombo-embolica. Molti pazienti manifestano una anemia emolitica positiva al Coombs e/o trombocitopenia immune. Queste due caratteristiche si osservano anche nella sindrome di Evans, la cui diagnosi può essere confusa con l’ALPS. Manifestazioni autoimmuni meno frequenti in ALPS includono anticorpi anti-nucleari, fattore reumatoide, neutropenia autoimmune, glomerulonefrite, uveite, epatite autoimmune, cirrosi biliare primaria, Guillain-Barré, vasculite, dermopatia lineare IgA, e anticorpi anti-fattore VIII con coagulopatia. Non si sa perché, al contrario di altre malattie autoimmunitarie, la malattia autoimmune mediata da anticorpi è principalmente diretta contro il sistema ematopoietico nei pazienti ALPS. Tuttavia, il fenotipo autoimmune è impreciso, come illustrato dalla scoperta di un paziente, inizialmente diagnosticato come lupus eritematoso sistemico (SLE), in cui successivamente si è evidenziato una mutazione di Fas ligando con apoptosi difettiva. Una domanda interessante è se la riduzione delle cellule CD4+CD25+ osservata in pazienti ALPS possa rappresentare un difetto in cellule regolatorie che contribuisce alla malattia autoimmune.
Nonostante la linfoproliferazione non sia inizialmente maligna, i pazienti ALPS hanno una propensione marcata a sviluppare tumori maligni a cellule B o T. Al momento, abbiamo osservato linfomi in pazienti ALPS di tipo I che presentavano mutazioni dominanti del DD di Fas che causavano severi difetti dell’apoptosi. Abbiamo trovato un aumento rispettivamente di 41 e 51 volte nell’incidenza di linfoma non-Hodgkin e linfoma di Hodgkin. I linfomi sono stati trovati in qualsiasi momento tra i 15 e i 48 anni dopo l’insorgenza dei sintomi ALPS, con un’età mediana di 21 anni per il linfoma non-Hodgkin e di 11 per i linfomi di Hodgkin. L’analisi dei tessuti linfomatosi dei pazienti ALPS non mostravano alcuna perdita eterozigotica di Fas o aumento della resistenza all’apoptosi. Era interessante che le mutazioni responsabili alteravano l’apoptosi, ma non i segnali indotti da Fas di NF-kB e di protein chinasi attivati da mitogeno (MAPK). Quindi, il contributo delle mutazioni di Fas alla linfomagenesi forse coinvolge effetti di blocco della morte e di promozione della crescita. E’ anche possibile che un aumentato numero di linfociti in generale possa fornire un pool più grande per la tumorigenesi.
In una descrizione clinica precoce di ALPS, Sneller e coll. hanno riconosciuto che ALPS assomigliava da vicino ai ceppi di topi lpr/lpr (lpr) e gld/gld (gld). In alcuni background genetici inbred, l’omozigosi di questi alleli determinava nei topi lo sviluppo di profonda linfoproliferazione che coinvolgeva le cellule DNT, ipergammaglobulinemia, autoanticorpi, malattia autoimmune, e linfomi. In maniera non sorprendente, questi ceppi di topi sviluppati naturalmente hanno difetti molecolari in alcuni degli stessi geni dei pazienti ALPS. I topi lpr e gld hanno mutazioni autosomiche recessive rispettivamente di Fas e FasL, il chè risultava in una loro espressione deficiente, mentre la variante lprcg ha una mutazione puntiforme di Fas che non lo rende funzionante. Nonostante il locus di Fas sia il determinante genetico primitivo, c’è un forte effetto del background del ceppo di topi inbred sul fenotipo autoimmune. Malattie gravi insorgono sul background MRL, mentre la malattia è sostanzialmente ridotta nel background B6 o BALB/c. Questi topi non sviluppano l’anemia emolitica autoimmune e la trombocitopenia che si vede nell’uomo in pazienti ALPS. Invece, mostrano alcune caratteristiche che ricordano la SLE (autoanticorpi anti-dsDNA, anti-Sm, anti-immunoglobuline) con una predilezione nello sviluppo di glomerulonefrite, poliartrite, sialoadenite, e, con minore frequenza, artrite o cirrosi biliare primitiva. Incrociando tra di loro ceppi lpr suscettibili e resistenti alla malattia, molti gruppi hanno fatto analisi linkage di ampie parti del genoma. La mappatura di modificatori genetici della malattia ha rivelato loci per la linfoproliferazione e per la produzione di anticorpi (per es., Lmb1, Lmb2, e Lmb3), sialoadenite (per es., Asm e Asm2), glomerulonefrite (per es., Agnm1, Agnm2, e Agnm3), e artrite (per es., Paam1 e Paam2). Il locus Agnm3 associato alla glomerulonefrite corrisponde al polimorfismo allelico del gene osteopontina. I polimorfismi di questo gene, che è altamente espresso nelle cellule T, corrisponde a differenze funzionali nei macrofagi in attivazione e nella produzione di anticorpi delle cellule B. E’ interessante che i poliformismi allelici dell’osteopontina possano influenzare la penetranza della malattia negli uomini che hanno una variante dell’ALPS chiamata ALD (descritta dopo).
In tutti tranne che nei pazienti più gravemente affetti , il decorso clinico di ALPS cresce e decresce nel tempo e spesso migliora con l’età. L’involuzione timica può diminuire la fuoriuscita delle cellule T, e si sa che la timectomia neonatale in topi lpr previene l’insorgenza della malattia. Le complicazioni cliniche sono correlate principalmente alla gravità della malattia. Possono intervenire infezioni dopo la splenectomia o in seguito al trattamento immunosoppressivo. Agenti nuovi, come il micofenolato mofetile, possono eliminare la necessità per cicli prolungati con corticosteroidi o per la splenectomia. E’ notevole che anche pirimetamina più sulfadossina hanno migliorato i sintomi in alcuni pazienti ALPS, probabilmente attraverso un meccanismo che coinvolge l’induzione dell’apoptosi linfocitaria attraverso una via mitocondriale alternativa. Sono stati pubblicati dei lavori sul trapianto curativo di midollo osseo in pazienti con mutazioni Fas di entrambi gli alleli e con malattia autoimmune e linfoproliferativa intrattabile. Tuttavia, il trattamento conservativo generalmente è sufficiente per controllare la malattia nella maggioranza dei pazienti.
Infine, varianti cliniche minori dell’ALPS riflettono forse difetti molecolari diversi e non caratterizzati nei meccanismi di omeostasi linfocitaria. Una frazione significativa di pazienti ALPS e simil-ALPS non presentano mutazioni nei geni che codificano per proteine coinvolte nel segnale di Fas. Una metà circa di questi pazienti non hanno difetti dell’apoptosi in seguito a stimolazione diretta con un anticorpo agonista anti-Fas. Nonostante la diagnosi di ALPS richieda la documentazione di alterata apoptosi dei linfociti maturi, la maggior parte dei laboratori si basano sulla valutazione dell’apoptosi indotta attraverso il recettore di morte Fas. Difetti dell’apoptosi mediata da Fas di solito coincidono con difetti della morte indotta dalla ristimolazione del TCR; tuttavia, è stato descritto un paziente ALPS con normale apoptosi mediata da Fas ma alterata apoptosi dovuta a stimolazione con fitoemagglutinina più IL-2. ALPS può anche derivare da difetti che coinvolgono vie intrinseche dell’apoptosi da recettori non di morte. Abbiamo recentemente caratterizzato un paziente ALPS che mostra le sue caratteristiche cliniche, ma ha difetti dell’apoptosi da mancanza di citochine con intatta morte mediata da Fas. Alcuni pazienti possono anche manifestare le principali caratteristiche cliniche dell’ALPS, con linfoproliferazione, difetti apoptotici, malattia autoimmune, e cancro, ma senza espansione di cellule DNT. Questa variante dell’ALPS è stata denominata malattia autoimmune linfoproliferativa (ALD). Nonostante il difetto(i) molecolare(i) deve (devono) ancora essere scoperto(i), i pazienti ALD condividono probabilmente con i pazienti ALPS una comune via alterata a valle rispetto al recettore Fas. In conclusione, c’è un certo numero di varianti e sottotipi clinici che si sovrappongono e che sarà molto interessante studiare a livello molecolare.
Diagnosi Molecolare
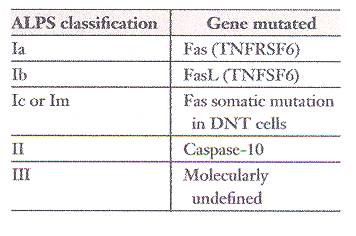
La diagnosi molecolare di ALPS comprende i seguenti tre, forse quattro, categorie principali così come i sottotipi molecolari selezionati (riassunti in tabella 2 e sul sito web http://research.nhgri.nih.gov/ALPS/). Per il tipo Ia, le mutazioni eterozigotiche possono essere trovate in qualsiasi punto della sequenza codificante di Fas, ma più della metà si trovano nell’esone 9, che codifica il DD intracitoplasmatico (vedi http://research.nhgri.nih.gov/ALPS/dist_fas_mutations.shtml).
In generale, le mutazioni consentono l’espressione di una versione anormale della proteina Fas che contiene un dominio pre-ligando di assemblaggio (PLAD) che ha un effetto dominante di interferenza. Nonostante ciò, ci sono eccezioni a questa regola. Per esempio, alcune mutazioni precoci dell’esone 2 essenzialmente eliminano l’espressione della proteina; questa osservazione solleva la domanda se l’aploinsufficienza possa causare la malattia in alcune circostanze. Recentemente, sono state prodotte alcune evidenze che supportano tale ipotesi. Il tipo Ib che coinvolge il FasL è molto meno frequente, anche se se ne conoscono molti casi. L’analisi molecolare dimostra che mutazioni puntiformi generano versioni mutanti della proteina FasL che interferiscono in maniera dominante. Il tipo Ic (o Im) è una ALPS che deriva da mutazioni somatiche nelle cellule DNT. La possibilità di mutazioni somatiche in cellule DNT dovrebbe essere ricercata in qualsiasi paziente simil ALPS che sembra non possedere alcuna mutazione di Fas, FasL, o caspasi-10, specialmente quelle che non hanno un chiaro difetto di apoptosi nei linfociti normali.
L’ALPS di tipo II coinvolge mutazioni nel gene di caspasi-10 (vedi http://research.nhgri.nih.gov/ALPS/alpsII_mut.shtml). All’inizio, sono stati riportati due casi, ma la rivalutazione della mutazione V410I ha rivelato che è ampiamente distribuita nelle popolazioni dell’Europa occidentale e ha fatto nascere la domanda sul proprio potenziale nel causare la malattia. Tuttavia, sono state documentate altre due mutazioni di caspasi-10 in pazienti ALPS senza mutazioni di Fas o di FasL. All’inizio, ci fu il suggerimento che anche le mutazioni di caspasi-8 potessero causare ALPS di tipo II. Tuttavia, nell’unica famiglia con mutazioni di caspasi-8 finora identificata, le caratteristiche della malattia costituiscono un’entità distinta, dal momento che non è stato osservato un aumento drammatico delle cellule DNT; questo fatto può essere responsabile della mancanza di molte particolarità dell’ALPS. Sono necessarie altre famiglie per determinare se le mutazioni di caspasi-8 possano causare un fenotipo ALPS vero e proprio.
Finora, il tipo III è stato usato per descrivere ALPS con patogenesi molecolare sconosciuta. E’ probabile che questa terminologia possa cambiare rapidamente con la scoperta di nuove anormalità molecolari. Quindi, i casi con una patogenesi molecolare sconosciuta diventeranno tipo IV, ecc. E’ probabile che questi casi non diagnosticati generino una messe di interessanti approfondimenti molecolari nella regolazione linfocitaria e nell’autoimmunità.
L’ALPS di tipo Ia svela Interferenza Dominante, Preassociazione di Fas, e cooperazione.
I pazienti con ALPS Ia hanno mutazioni eterozigotiche di Fas che alterano l’apoptosi. Sono stati descritti finora più di 200 pazienti ALPS Ia. La grande maggioranza di loro gemmano mutazioni localizzate nella regione del gene che codifica il dominio intracellulare di Fas, con una preponderanza (60%) nel DD. Queste mutazioni sono soprattutto mutazioni missense o nonsense che generano proteine mutanti, al contrario delle mutazioni che determinano una completa perdita di espressione. E’ stato visto che le proteine mutanti riducono fortemente il legame con FADD e di conseguenza alterano il reclutamento e l’attivazione delle caspasi anche in presenza della proteina normale. Perché le mutazioni dominanti hanno questo effetto? Questo non sembra essere dovuto all’espressione selettiva delle catene mutanti. Piuttosto, le catene mutanti entrano in complessi con le catene buone, e questi complessi misti non trasducono efficacemente il segnale di morte. In termini genetici, ciò costituisce l’interferenza dominante. Si presume che l’associazione di catene buone e cattive possa essere dovuta al reclutamento o al legame crociato delle catene in complessi trimerici misti grazie al legame del ligando.
Nell’ALPS tipo Ia insorgono anche mutazioni della regione del gene che codifica per il dominio extracellulare di Fas. All’incirca la metà di queste mutazioni portano a forme tronche di Fas, e l’altra metà risulta in una modificazione della sequenza amminoacidica. Ancora, la maggior parte di queste mutazioni si dimostrano interferenti dominanti nonostante il fatto strano che non riescono a legare il ligando. Queste sorprendenti osservazioni hanno portato alla teoria che le catene del recettore Fas formano trimeri in maniera indipendente dal ligando. Adesso è stato dimostrato direttamente che Fas, TNFR1, e TNFR2 si auto-associano in forma di oligomeri, indipendentemente da qualsiasi ligando, attraverso il PLAD, un dominio N-terminale di circa 50 amminoacidi. Per Fas, il PLAD ed il sito di legame del ligando sono distinti. Questo fatto spiega perché le catene mutanti di ALPS con alterazione del legame a FasL possono formare trimeri misti con catene di Fas originali. E’ stato trovato che PLAD è intatto in tutti i pazienti con ALPS tipo Ia con mutazioni dominanti di interferenza. Inoltre, il preassemblaggio di Fas è necessario per il legame di FasL e per la corretta formazione del DISC. Come il preassemblaggio di Fas sia legato al segnale a valle, e perché il Fas preassemblato non forma un DISC in assenza di FasL? Si possono immaginare due conformazioni allosteriche principali (o orientamento delle catene): inattiva e attiva. Il legame di FasL medierebbe un cambiamento attivante che si propagherebbe alla porzione intracellulare di Fas per indurre un comlesso stechiometrico Fas:FADD di 3:3. Alcune evidenze suggeriscono che questo complesso è formato in maniera cooperativa ed è altamente stabile. Il modello di preassociazione ha importanti implicazioni oltre a spiegare l’interferenza dominante in ALPS. Spiega come catene recettoriali distinte che legano lo stesso ligando, come TNFR1 e TNFR2, possano formare complessi omotipici, dal momento che sembra che PLAD di ciascun recettore sia specifico per il proprio legame. La modificazione conformazionale dei recettori dimerici preassemblati in seguito allo stimolo sono stati descritti anche per il recettore dell’eritropoietina ed altri recettori di superficie. Il fatto che il preassemblaggio sia stato osservato anche per il TNFR1 e il TNFR2 suggerisce che altri membri della superfamiglia del TNFR possano avere un PLAD e siano quindi suscettibili a mutazioni di interferenza dominante.
Accanto alla dinamica delle interazioni proteiche nel DISC, anche un ordine di interazioni più alto come quelle che portano agli SPOTS possono partecipare ai difetti di segnale in ALPS. La formazione di un ordine più alto di complessi può richiedere le interazioni cooperative tra complessi individuali di recettori oltre al reclutamento cooperativo di proteine di segnale. Per esempio, la trasfezione transiente di quantità crescenti di alleli mutanti di Fas in cellule Jurkat esprime un potente effetto di interferenza transdominante nel prevenire l’associazione di FADD a caspasi-8. La disgregazione delle interazioni cooperative può spiegare perché mutazioni dominanti – alcune delle quali inibiscono solo parzialmente il legame FADD:Fas – possono deprimere marcatamente il segnale apoptotico. Una mutazione DD è stata trovata in un paziente ALPS che ha consentito la formazione del DISC ma ha alterato SPOTS ed il conseguente taglio di caspasi-8. La cooperazione può servire per fare del segnale una risposta tutto o nulla a livello della stimolazione del recettore da parte del ligando. Holler et al hanno recentemente dimostrato che sono necessari due trimeri di FasL per innescate una potente formazione del DISC. Tuttavia, la formazione di superaggregazioni è anche indipendente da segnali trasdotti dalla porzione intracellulare di Fas al dominio extracellulare (segnale “dentro-fuori”) dal momento che un ridotto reclutamento di FADD e caspasi-8 in pazienti ALPS tipo Ia abolisce anche la formazione di SPOTS. Quindi, la cooperazione rende i segnali efficienti ma anche vulnerabili all’interferenza dominante.
La caspasi-10 è un attore principale nell’apoptosi indotta dai recettori di morte
Il recente rapporto su due pazienti ALPS che hanno mutazioni di caspasi-10 ha svelato il ruolo cardinale di questa proteasi durante l’apoptosi indotta da recettore di morte. I mutanti di caspasi-10 mostrano una attività enzimatica e di auto-alterazione significativamente ridotte, ed i linfociti di questi pazienti esibiscono una alterazione della morte indotta da Fas, CD3 e TRAIL. In linea con queste osservazioni, caspasi-8 e -10 sono reclutate ed attivate a livello di DISC in PBL o cellule Jurkat trattate con FasL. E’ probabile che queste caspasi cooperino, dal momento che mutanti di caspasi-8 e -10 possono inibire l’un l’altra in maniera crociata e possono entrare nello stesso complesso recettoriale. Tuttavia, la relazione tra queste due caspasi molto strette rimane oscura. Nonostante uno studio suggerisca che caspasi-10 non possa sostituire caspasi-8 nella morte indotta da Fas o da TRAIL, alcuni lavori dimostrano che i due enzimi possono innescare l’apoptosi indipendentemente l’uno dall’altro. Sono immaginabili due diversi ruoli di queste proteasi, dal momento che le regioni coinvolte nel riconoscimento e nel legame del substrato sono chiaramente diverse. Inoltre, caspasi-10 così come caspasi-8 stimola la morte cellulare attraverso il coinvolgimento di Bid e attivazione caspasica, ma caspasi-10 non taglia la proteina che interagisce col recettore (RIP), un substrato canonico di caspasi-8. E’ interessante notare che un paziente con una mutazione deleteria di caspasi-10 esibiva un difetto precedentemente sconosciuto nell’apoptosi delle cellule dendritiche in risposta a TRAIL che è associato ad un accumulo di cellule dendritiche nelle aree delle cellule T all’interno dei linfonodi. Sono state anche descritte altre mutazioni di caspasi-10 che inattivano l’apoptosi in linfomi non-Hodgkin così come nel cancro gastrico.
Tipo III e variante di ALPS
Ci sono due importanti categorie di pazienti dentro lo spettro delle ALPS che non rientrano facilmente nei gruppi finora menzionati. Il primo gruppo si riferisce all’ALPS di tipo III. Questi pazienti soddisfano i criteri clinici dell’ALPS ed esibiscono una bassa resistenza all’apoptosi indotta da Fas ma non presentano alcuna mutazione nei geni che codificano per Fas, FasL, FADD, caspasi-8, o caspasi-10. In alcuni di questi pazienti, FADD e caspasi-8 sono reclutati normalmente nel DISC in seguito a stimolazione di Fas. Tuttavia, la formazione del DISC è abortiva, dal momento che caspasi-8 rimane largamente non modificata a livello del recettore. Quest’osservazione suggerisce che la modificazione ed il rilascio di caspasi-8 attiva dal DISC sono strettamente regolati, anche se il meccanismo completo è sconosciuto. Noi ipotizziamo che anche le mutazioni di questi regolatori possano portare allo sviluppo di ALPS. Tra i possibili regolatori, c-FLIP è un candidato attraente dal momento che blocca l’attivazione di caspasi-8 a livello recettoriale. Tuttavia, topi transgenici che esprimono FLIPL in eccesso nel compartimento delle cellule T non esibiscono alcun accumulo di cellule T in organi linfoidi secondari come avviene invece nei topi MLR/lpr. E’ anche plausibile che difetti in molecole che controllano le modificazioni conformazionali di Fas o la sua aggregazione ed internalizzazione possano portare alla malattia. Altri soci citoplasmatici di Fas meno caratterizzati, come Daxx, RIP, o FAF-1, potrebbero essere coinvolti. RIP che contiene un DD e una chinasi a serina/treonina è stata descritta come componente del DISC di Fas. Sembra che RIP giochi un ruolo critico nella morte non apoptotica in seguito a stimolazione di Fas quando le caspasi sono inibite. Un’altra categoria di pazienti, chiamati varianti di ALPS, esibiscono il fenotipo caratteristico di ALPS nonostante la sensibilità dei loro linfociti all’uccisione da Fas sia normale.
Modificatori Genetici della Malattia ALPS
ALPS mostra una penetranza ed una gravità variabile. Più dei due terzi di pazienti hanno mutazioni eterozigotiche di Fas e mostrano un intervallo di fenotipi che va dalla completa mancanza di sintomi ad un’autoimmunità che mette in pericolo la vita del paziente. Uno dei principali fattori sembra essere la natura della mutazione Fas e come essa influenzi il segnale apoptotico. E’ stato scoperto che un paziente era un composto eterozigotico di due mutazioni Fas e presentava un fenotipo clinico grave. Tra i pazienti con mutazioni eterozigotiche di Fas, la localizzazione della mutazione influenza la penetranza e la gravità. Per esempio, alleli con interferenza dominante codificanti alterazioni del DD che influenzano severamente il segnale apoptotico sono associate con una maggiore penetranza e gravità della malattia. Al contrario, mutazioni nella regione del gene che codifica il dominio extracellulare, anche se è interferente dominante, sono meno penetranti e causano una malattia più lieve. Anche una minoranza di pazienti che hanno mutazioni aploinsufficienti nella regione del gene che codifica il dominio extracellulare tendono ad avere una malattia più lieve. Nonostante ciò, anche all’interno di questi ampi gruppi, c’è una eterogeneità significativa. Per ogni singolo paziente, non è infrequente che molteplici membri della famiglia che presentano la stessa mutazione manifestino alterata apoptosi in vitro ma non sviluppano la malattia ALPS. Questa situazione viene mimata dalla generazione di topi transgenici per mutazioni nel DD di Fas che erano incrociati nei ceppi FVB/N o MRL. In paragone ai ceppi transgenici FVB/N o MRL, i topi FVB/N X MRL transgenici per mutazioni Fas identiche hanno una malattia autoimmune incompletamente penetrante che correla con il grado del difetto apoptotico.
L’esistenza di membri sani nella famiglia di pazienti ALPS e l’influenza del sottofondo genetico inbred sul fenotipo dei topi lpr o gld suggerisce fortemente l’esistenza di geni modificatori. Un gene modificatore potrebbe essere definito come un gene codificato da un locus non legato alla mutazione ALPS primaria che determina il fenotipo finale della malattia. Molti geni modificatori o di suscettibilità sono stati legati ad altre malattie autoimmunitarie e sono quindi dei candidati come modificatori dell’ALPS. Forse l’associazione più frequente è quella tra gli alleli specifici dell’antigene leucocitario umano (HLA) con le malattie autoimmunitarie. Tuttavia, l’analisi di un grande numero di pazienti ALPS e dei loro congiunti non ha portato ad alcuna associazione specifica dell’HLA con l’esacerbazione della malattia, anche se forse HLA-B44 può avere un effetto protettivo. Questo risultato è sorprendente perché HLA-B44 è stato precedentemente associato alla malattia di Crohn. Anche alcune forme ereditarie di caspasi-10 possono fungere come modificatori della malattia in pazienti ALPS. Oltre alla caspasi-10, altre molecole di morte cellulare possono modulare la malattia in presenza di mutazioni Fas. E’ stato recentemente descritto un paziente con una mutazione composta eterozigotica dello splicing di Fas e una mutazione della perforina, che era stata ereditata separatamente da genitori sani. Tuttavia, non era chiaro se l’alterazione di perforina rappresentasse un poliformismo o una mutazione funzionale. In una famiglia diversa, è stata trovata la stessa alterazione di perforina insieme ad una mutazione di Fas, e nonostante ciò quell’individuo non ha sviluppato ALPS. I polimorfismi di CTLA4 (cytotoxic T lymphocyte-associated antigen-4) sono stati associati con malattia autoimmune della tiroide e con il diabete mellito tipo 1. Tuttavia, l’analisi di un piccolo numero di pazienti ALPS non ha rivelato alcuna relazione con i polimorfismi CTLA4.
Accanto alla modificazione della penetranza nell’ALPS, altri geni possono influenzare la presentazione clinica della malattia. Di 151 pazienti ALPS attualmente seguiti dal National Institute of Health, molti hanno altre condizioni infiammatorie superimposte. Sono state osservate febbri periodiche che suggeriscono una sindrome periodica associata al recettore TNF (TRAPS) in sei pazienti ALPS, ed è stato trovato che due di questi individui avevano un polimorfismo funzionale R92Q nel gene p55 TNF-R1. La frequenza di questo polimorfismo è più elevata in TRAPS ed altri disordini come l’artrite reumatoide in paragone alla popolazione generale. Il meccanismo biochimico attraverso cui il polimorfismo R92Q contribuisce alla malattia non è chiaro. Una situazione simile esiste per un altro paziente ALPS, che ha anche la Febbre Familiare Mediterranea con l’associazione di un polimorfismo funzionale del gene pirina (E148Q). Inoltre, uno dei pazienti ALPS con il polimorfismo R92Q per p55TNF-R1 ha un’alterazione del gene caspasi-10; questo fatto suggerisce che, modificando condizioni infiammatorie coesistenti, questi geni possono influenzare la gravità e la penetranza della malattia ALPS.
STATO DI DEFICIENZA DI CASPASI-8 (Caspase-8-deficiency state – CEDS)
Presentazione Clinica
Lo studio di un ampio spettro di pazienti che mostrano alcune caratteristiche dell ‘ALPS ha rivelato nuovi ed insospettati ruoli biologici per le molecole che funzionano nella morte programmata. Abbiamo trovato due fratelli con molte caratteristiche ALPS che sorprendentemente soddisfacevano anche i criteri diagnostici per l’immunodeficienza primitiva comune variabile (CVID). E’ stato visto che questi bambini avevano delle mutazioni omozigotiche inattivanti di caspasi-8. Era sorprendente che lo stato di deficienza di caspasi-8 (CEDS) fosse compatibile con sviluppo embrionale nell’uomo dal momento che il silenziamento del gene caspasi-8 causava letalità embrionale nei topi. Una spiegazione potrebbe essere data dalla presenza nell’uomo, ma non nel topo, di caspasi-10 che è altamente correlato. I bambini affetti da CVID hanno infezioni broncopolmonari ricorrenti ed infezioni mucocutanee da herpes virus. Nonostante numeri linfocitari elevati, le immunoglobuline seriche erano ridotte, e l’immunizzazione con l’antigene polisaccaridico determinava una scarsa risposta anticorpale. Inoltre, l’attivazione delle cellule B e T (attraverso il recettore per l’antigene) o delle cellule Natural Killer (NK)(attraverso il recettore per Fc o quello di attivazione NK) erano tutte alterate. Nonostante che l’immunodeficienza fosse la loro caratteristica clinica più stringente, i pazienti avevano anche un ingrandimento linfoide secondario, alterata apoptosi linfocitaria in vitro, ed occasionali innalzamenti al confine del patologico delle cellule DNT.
Nonostante le mutazioni di caspasi-8 spiegassero l’apoptosi e l’omeostasi linfocitaria anormali, le scoperte cliniche di immunodeficienza puntavano anche ad un ruolo, finora non messo in evidenza, di caspasi-8 nell’attivazione linfocitaria. Usando una nuova tecnologia di trasfezione per introdurre piccoli RNA di interferenza specifici per caspasi-8 in linfociti umani primari, abbiamo scoperto che caspasi-8 era effettivamente necessaria in linfociti normali per la loro attivazione attraverso i recettori per l’antigene delle cellule B e T, i recettori Fc e 2B4 delle cellule NK, ed il recettore Toll-like 4 (TLR4). Le nostre osservazioni spiegano la strana scoperta che gli inibitori farmacologici delle caspasi possano interferire con l’attivazione in vitro dei linfociti T. Queste scoperte hanno anche in essenza trovato conferma nei topi in cui le cellule T o B erano state rese deficienti di caspasi-8 in maniera condizionale attraverso ricombinazione omologa. I topi knock-out nelle cellule T possono morire per una malattia autoimmune insolita caratterizzata da infiltrazione linfocitaria del polmone, rene, e parenchima epatico. Il follow-up clinico dei pazienti deficienti di caspasi-8 ha rivelato bronchiectasie, così come autoanticorpi o una anemia emolitica autoimmune compensata. Se questi nuovi sintomi riflettano complicazioni della CVID, che in se stessa può essere associata con malattia autoimmune, e/o una forma frustra di ALPS al momento non è chiaro. La sindrome clinica che ne risulta condivide alcune caratteristiche con l’ALPS, ma chiaramente ha anche caratteristiche peculiari. Il suo marchio clinico più stringente è l’immunodeficienza linfoide primitiva combinata con suscettibilità alle infezioni. E’ importante che, nonostante una estesa letteratura su caspasi-8 e morte cellulare programmata da Fas in tessuti non linfoidi, finora i pazienti CEDS non abbiano manifestato anormalità primitive in altri sistemi d’organo. In conclusione, queste scoperte sottolineano l’importanza di esaminare le vie critiche nell’uomo piuttosto che confidare sui topi o altri modelli sperimentali. Chiaramente, ci sono limitazioni importanti all’uso di studi sui topi per capire le malattie umane.
Effetti molecolari della deficienza di caspasi-8
Il possibile coinvolgimento di caspasi-8 nell’attivazione linfocitaria indotta dal recettore per l’antigene è stata sconcertante ad un primo sguardo in quanto le funzioni conosciute delle caspasi erano limitate alla maturazione di citochine ed alla mediazione della morte cellulare programmata. Il ruolo cardine della caspasi-8 sia nell’attivazione che nella morte dei linfociti è stata finalmente dimostrata in modo chiaro. Queste osservazioni hanno esteso le funzioni delle caspasi includendo ruoli di mediatori del segnale intracellulare durante l’attivazione e la proliferazione cellulare. Le implicazioni dell’evoluzione di questo doppio ruolo per le caspasi e per altre molecole di morte sono state affrontate da altri. Queste osservazioni sollevano anche il problema della via molecolare su cui caspasi-8 esercita il proprio effetto durante l’attivazione linfocitaria.
Recentemente, abbiamo dimostrato in maniera definitiva che caspasi-8 è essenziale per l’attivazione di NF-kB indotta dal recettore per l’antigene. Durante la stimolazione antigenica delle cellule T, il fattore di trascrizione NF-kB induce geni che regolano la proliferazione cellulare e la sopravvivenza delle cellule, quali per esempio IL-2 e CD25 (catena α del recettore per l’IL-2 ad alta affinità). Le componenti di legame al DNA di NF-kB sono costitutivamente presenti nel citosol legati a specifiche proteine inibitorie chiamate inibitori di kB (IkB). L’attivazione di NF-kB coinvolge la fosforilazione e la degradazione di IkB mediata dall’ubiquitina. La degradazione di IkB consente ad NF-kB di traslocare nel nucleo e governare la trascrizione di un gran numero di geni legandosi a siti specifici delle regioni di regolazione genica nel DNA. La fosforilazione di IkB è operata dal complesso della chinasi IkB (IKK), che è composto da due chinasi cataliticamente attive (IKKα e IKKβ) ed una subunità regolatoria cataliticamente inattiva (IKKγ, anche conosciuta come NEMO). Come il segnale venga convogliato dal recettore per l’antigene al complesso IKK non è stato chiarito appieno. Tuttavia, la recente scoperta di tre proteine critiche, CARMA1, BCL10, e MALT1, a monte di IKK ha ulteriormente chiarito la via di attivazione di NF-kB. Adesso è accettato che la proteina chinasi C (PKC) indipendente da Ca2+, ϴ è rapidamente reclutata nei raft lipidici di membrana nella sinapsi immunologica in seguito alla stimolazione del recettore per l’antigene (Figura 2). PKCϴ può innescare l’attivazione di IKK iniziando la formazione di un grande complesso che include CARMA1, BCL10, e MALT1, e che si chiama complesso CBM. Approcci genetici e biochimici hanno stabilito il ruolo cardine di CARMA1 a monte di un complesso di preassociazione tra BCL10 e MALT1. Recentemente, Lee et al. hanno mostrato che la chinasi 1 dipendente da 3-fosfoinositide (PDK1) è un ponte che lega i complesso IKK e CBM al PKCϴ. Come il complesso CBM attivi IKK non è ancora chiaro. Si pensa che l’attivazione di IKK richieda l’ubiquitinazione non canonica di NEMO sulla lisina K63. Questa potrebbe essere ottenuta grazie al legame del complesso E2 di coniugazione dell’ubiquitina (composto da UBC13 e MMS2) a MALT1 dopo la sua oligomerizzazione o, alternativamente, attraverso il legame di TRAF6, ligasi del dominio RING dell’ubiquitina. Questa modificazione di NEMO indurrebbe la fosforilazione e l’attivazione di IKK.
Le nostre evidenze adesso mostrano che caspasi-8 sembra essere un nesso essenziale tra i complessi CBM e IKK (figura 2). Questa proteasi interagisce fisicamente sia con CBM che con IKK, e la sua assenza preclude l’intera formazione del signalosoma indotto dall’attivazione del recettore (ARIS) e previene di fatto l’attivazione di IKK. Questo ruolo inaspettato di caspasi-8 nell’attivazione linfocitaria spiega l’immunodeficienza caratteristica in pazienti CEDS. La difettiva induzione di NF-kB durante l’attivazione di cellule B, T, ed NK rende gravemente incapaci gli eventi di espressione di geni critici. Ancora non si sa come la proteina caspasi-8 assembla l’ARIS e che cosa è compreso nel complesso di segnale finale. La mutazione del sito attivo cisteina inibisce la funzione della caspasi-8 di attivazione di NF-kB; questo risultato implica chiaramente che il complesso include un substrato proteolitico cruciale. L’identificazione di questo substrato fornisce un considerevole approfondimento sul come la via funziona. E’ anche coinvolta la proteina adattatrice FADD, anche se non c’è nessuna evidenza che venga tagliata. FADD è reclutata transitoriamente nel CBM, e se giochi un ruolo nell’assemblaggio di ARIS deve essere studiato ulteriormente. E’ stato scoperto che la deficienza genetica di FADD o l’espressione transgenica di un mutante interferente dominante di FADD altera l’attivazione delle cellule T sia indotta da recettori di morte che da mitogeni ed antigene. Lavori futuri dovrebbero puntare a determinare se il regolatore di caspasi-8 FLIP fa parte dell’ARIS o se regola l’attivazione di caspasi-8 o eventi di segnale a valle, come è stato suggerito precedentemente. E’ interessante che l’attività enzimatica ma non l’automodificazione della caspasi-8 sia necessaria durante l’attivazione di NF-kB indotta dal recettore per l’antigene. E’ probabile che l’attività di caspasi-8 generata all’interno dell’ARIS sia più debole rispetto a quella che si genera durante la formazione del DISC, dal momento che l’enzima non viene modificato. Inoltre, alcune evidenze suggeriscono che non vi è rilascio di caspasi-8 attiva dall’ARIS, in paragone alla formazione del DISC, dove l’enzima attivo è rilasciato proteoliticamente dal prodominio. L’attività locale e ristretta di caspasi-8 nell’ARIS probabilmente innesca eventi pro-sopravvivenza ed evita il rilascio di proteasi nel citosol, dove potrebbe trovare substrati dell’apoptosi. Quindi, a seconda della propria posizione, della concentrazione, e dei partners, la caspasi-8 controlla il fragile equilibrio tra vita e morte nei linfociti durante le risposte immuni.
DISORDINI CORRELATI DELL’OMEOSTASI LINFOCITARIA
L’uso di topi knock-out ha reso possibile l’identificazione di diversi altri geni che regolano la morte cellulare programmata durante la normale omeostasi linfocitaria. Questi geni possono fornire indizi su malattie umane che non sono state ancora scoperte. La tabella 3 elenca ceppi murini che manifestano difetti dell’apoptosi linfocitaria con linfoproliferazione ed altre caratteristiche che ricordano l’ALPS nell’uomo. Poiché in circa il 20% dei pazienti con ALPS (tipo III) non sono stati identificati difetti genetici, gli studi sui topi possono fornire dei candidati di potenziali difetti in questi individui.
Un segnale anormale dell’IL-2 risulta in un quadro simile all’ALPS nei topi. Topi geneticamente deficienti di IL-2 o delle subunità IL-2Rα (CD25) e IL-2Rβ (CD122) del recettore dell’IL-2 sviluppano anemia emolitica autoimmune, colite, linfoproliferazione, e morte precoce. L’unico paziente riportato con una mutazione deleteria di IL-2Rα presentava una grave malattia autoimmune multisistema. Nonostante le sue proprietà di promozione della crescita, l’IL-2 è anche necessaria per la morte programmata delle cellule T dopo la ristimolazione del recettore per l’antigene. Una morte difettiva dopo la ristimolazione del TCR è stata dimostrata direttamente quando le cellule T venivano trattate all’inizio con dosi limitanti di IL-2 ed è stata confermata usando cellule di topi IL-2-/- o IL-2Rα-/-. Morte difettiva mediata attraverso il recettore di morte Fas è stata osservata in cellule T di topi IL-2-/- o IL-2Rα-/-. I difetti apoptotici comparivano in vivo, appena la somministrazione di anticorpi neutralizzanti anti-IL-2 con l’antigene risultavano nella persistenza di cellule T transgeniche per il TCR specifiche per l’antigene trasferiti in modo adottivo, ed è stata vista una alterata delezione periferica di cellule T Vβ8+ dopo somministrazione del superantigene batterico enterotossina B stafilococcica (SEB) in topi trattati con anticorpi bloccanti anti-IL-2Rα. Questi risultati sono stati confermati in modelli murini simili. L’IL-2 regola molti geni che influenzano l’apoptosi, e differenze minime tra questi modelli murini possono riflettere variazioni nei bersagli disturbati da alterazione di segnali a valle dell’IL-2.
Studi successivi sembra che possano sfidare l’idea che un’incapacità intrinseca delle cellule T di morire in assenza di segnale appropriato dell’IL-2 contribuisca alla malattia, ma questi hanno omesso di considerare la possibilità di meccanismi compensatori di morte cellulare. L’iperattivazione delle cellule T e le anormalità emopoietiche nei topi IL-2Rβ-/- può essere corretta dal trasferimento adottivo di cellule CD8+CD122+ altamente purificate che esprimono TNF, Perforina, e Granzyme B ma non necessitano di Fas o FasL. Al contrario, il trasferimento di cellule CD8+CD122– altamente purificate esacerba la malattia. Dal momento che è stato visto precedentemente che la deplezione anticorpale in vivo di cellule T CD4 riduce la produzione di autoanticorpi e l’anemia emolitica, questi risultati suggeriscono che le cellule CD8+CD122+ costituiscono una potente popolazione regolatoria equipaggiata per uccidere cellule T che causano malattia. I topi IL-2Rβ-/- non hanno cellule CD4+CD25+. Nonostante che il trasferimento adottivo di popolazioni arricchite in cellule CD4+CD25+ correggesse la malattia in topi IL-2Rβ-/-, cellule CD4+CD25+ altamente purificate erano chiaramente meno capaci rispetto a cellule CD4+CD122+. Studi recenti hanno mostrato che cellule T regolatorie CD4+CD25+ possono esercitare effetti soppressivi attraverso il Granzyme B o la Perforina; questi studi sollevano la possibilità che queste cellule possano agire uccidendo le cellule T che causano la malattia. Anche i topi IL-2Rβ-/- non hanno cellule CD4+CD25+, e sembra che il trasferimento adottivo di cellule CD4 originali sia egualmente o appena più efficace delle cellule CD8 nel migliorare la malattia. Tuttavia, questo studio era limitato a campioni di piccola taglia e grande variabilità da topo a topo, così come dal fallimento nella separazione di cellule CD122+ da cellule CD122– nelle preparazioni di CD8 usate per il trasferimento adottivo. Quindi, questi studi non hanno confutato l’importanza dell’IL-2 per l’induzione dell’apoptosi nelle cellule T. Il ruolo delle cellule regolatorie come potenziale modo alternativo di delezione linfocitaria e tolleranza sarà un argomento interessante per ricerche future.
Nel loro insieme questi risultati portano alla predizione che citochine correlate che usano la componente recettoriale della catena gamma (γc) comune, che partecipa anche al segnale dell’IL-2, promuova l’apoptosi delle cellule T. Nonostante che molti gruppi abbiano inizialmente riportato che altre citochine non possano sostituire l’IL-2, abbiamo mostrato che date concentrazioni elevate sufficienti a guidare le cellule T nel ciclo cellulare, prima dell’esposizione di cellule IL-2Rα-/- a IL-4 o IL-7 restaura la morte dopo ristimolazione del TCR. Altri investigatori hanno dimostrato anche che IL-2, IL-4, IL-7 e IL-15 possono promuovere la morte di cellule IL-2Rβ-/- (l’IL-2Rβ è anche IL-15Rβ e serve come componente dell’IL-15R). Topi o persone geneticamente deficienti di γc esprimono una grave immunodeficienza e generalmente muoiono per infezioni precoci durante la loro vita a meno che non venga effettuato un trapianto curativo di midollo osseo. Tuttavia, topi vecchi sviluppano splenomegalia con accumulo di cellule T CD4, così come lesioni infiammatorie della malattia intestinale. Allo stesso modo, c’è un caso clinico di un paziente umano incompletamente immunodeficiente con una mutazione di splicing nella catena γc che possedeva linfociti periferici ed ha sviluppato una grave colite. E’ stato visto che topi deficienti in γc avevano un’alterata delezione periferica dopo somministrazione di SEB, con diminuita espressione di Bcl-2 e di FasL (anche se mantenevano la sensibilità a Fas). E’ interessante non sia stato riportato che topi deficienti in IL-4, IL-4Rα, IL-7, IL-7Rα, IL-15 o IL-15Rα sviluppino malattie linfoproliferative o autoimmuni. Tutto considerato, queste scoperte sottolineano l’importanza critica in particolare del segnale dell’IL-2 nell’omeostasi linfocitaria in vivo.
Nonostante che gli studi in pazienti ALPS abbiano stabilito l’importanza fisiologica delle molecole coinvolte nella via estrinseca dell’apoptosi controllata dai recettori di morte, non esistono studi paragonabili nell’uomo su molecole che partecipano nella via mitocondriale intrinseca dell’apoptosi. Sono stati generati topi resi geneticamente deficienti in molte di queste molecole candidate, e molti manifestano fenotipi che suggeriscono come questi geni possano contribuire a forme non caratterizzate di ALPS nell’uomo. Per esempio, in seguito a stimolazione del recettore di fattori di crescita, la chinasi fosfoinositolo-3-fosfato (PI3K) genera il secondo messaggero lipidico PIP3, che attiva la protein chinasi B a serina/treonina (PKB)/Akt. PKB/Akt a sua volta promuove la sopravvivenza cellulare attraverso effetti molteplici, tra cui l’inibizione della traslocazione dei membri pro-apoptotici della famiglia di Bcl-2, Bax e Bak, verso i mitocondri. Bax e Bak attivano la via intrinseca dell’apoptosi permeabilizzando i mitocondri e quindi rilasciando citocromo c che si associa ad Apaf-1 e caspasi-9, con conseguente attivazione caspasica. Altri membri della famiglia di Bcl-2 come Bim o Bid possono regolare l’attività di Bax e Bak. Bid è particolarmente interessante perché può far confluire la via estrinseca di morte nella via intrinseca attraverso la capacità di caspasi-8 di attivare Bid. In questo quadro generale, topi transgenici per forme mutanti di PI3K o PKB/Akt costitutivamente attive specifiche delle cellule T sviluppano linfoproliferazione, malattia autoimmune, linfomi, e difetti apoptotici. L’omologo di fosfatasi e di tensina (PTEN) limita il pool disponibile di PIP3 e quindi ha effetto pro-apoptotico. Topi in cui PTEN è stato deleto nei linfociti in maniera eterozigotica o condizionale sviluppano un fenotipo simile ad ALPS. Sono state valutate anche molecole che agiscono ancora più a valle nella via intrinseca rendendo i topi geneticamente deficienti in vari membri pro-apoptotici della famiglia Bcl-2. Topi deficienti in Bax o Bim sviluppano malattia linfoproliferativa, e, nel caso di Bim, anche malattia autoimmune. Potrebbe essere dimostrata un’apoptosi linfocitaria alterata qualora topi deficienti di Bax vengano incrociati con topi deficienti in Bak. Anche l’espressione transgenica dell’anti-apoptotico Bcl-2 nelle cellule B causa una malattia simile all’ALPS. Per geni che causano letalità embrionale, è stato valutato il ruolo nell’omeostasi dei linfociti maturi attraverso la ricostituzione di topi deficienti in RAG (recombinase activating gene), che non hanno cellule B e T. Usando questo approccio, il trasferimento adottivo di cellule con un citocromo c mutante che non si esprime ha dato origine a malattie linfoproliferative ed alterata apoptosi in seguito a ristimolazione del TCR, irradiazione-gamma o UV. Anche il trasferimento adottivo di cellule deficienti per caspasi-3 è risultato in malattia linfoproliferativa ed alterata apoptosi alla ristimolazione del TCR o del Fas, come ci si sarebbe aspettato per una caspasi effettrice che partecipa sia alla via estrinseca che intrinseca dell’apoptosi.
Infine, sono stati generati altri topi knock-out in cui il ruolo di alcuni fattori di trascrizione e di altri regolatori della morte cellulare programmata sono stati caratterizzati meno bene. In base alla discussione precedente, queste proteine regolano forse l’IL-2 o varie altre molecole pro-apoptotiche o anti-apoptotiche che funzionano nelle vie estrinseca o intrinseca dell’apoptosi. Alla luce di ciò, è interessante che il segnale attraverso il recettore di morte Fas o attraverso il TCR risulta in attivazione di NF-kB, che di solito antagonizza effetti simultanei di morte. Questo meccanismo può contribuire al linfomagenesi nei pazienti ALPS. Quindi, mutazioni geniche che influenzano l’attivazione di NF-kB possono alterare l’omeostasi linfocitaria attraverso i loro effetti sull’apoptosi. Per esempio, topi resi geneticamente deficienti di Par-4, un inibitore atipico di PKC che normalmente inibisce l’attivazione di NF-kB, manifestano iperproliferazione.
In conclusione, topi resi geneticamente deficienti per ricombinazione omologa sono stati utili nell’identificazione di potenziali geni che governano l’omeostasi linfocitaria e la tolleranza. In particolare, è probabile che i geni coinvolti nel segnale dell’IL-2, i geni coinvolti nelle vie intrinseca ed estrinseca dell’apoptosi, ed alcuni fattori di trascrizione, tra cui quelli che regolano l’attivazione di NF-kB, siano responsabili di alcuni casi di ALPS tipo III.

Tabella 3. Ceppi mutanti di topi con fenotipi che assomigliano alla sindrome autoimmune linfoproliferativa dell’uomo.
CONCLUSIONI
Lo studio di persone con difetti genetici rari è possibile grazie a nuove scoperte tecnologiche che hanno reso capace manipolazioni molecolari ed analisi scientifiche prima impossibili. Queste studi sono completati dalle conoscenze sulla patogenesi delle malattie dovuta a studi medici su singoli pazienti e su popolazioni di pazienti. Due esempi di questo nuovo potente approccio sono discusse in questa rassegna. Studi in pazienti con ALPS e CEDS hanno fatto luce considerevole sugli eventi normali della trasduzione del segnale che porta alla morte cellulare programmata, attivazione, ed omeostasi linfocitaria nell’uomo.
Questi studi hanno portato un certo numero di approfondimenti precedentemente non apprezzati dal lavoro sui modelli sperimentali. I pazienti ALPS mostrano che le conseguenze della difettosa apoptosi sono malattia linfoproliferativa, autoimmunità e linfoma. Nonostante l’identificazione di modificatori di malattie genetiche rimanga irrisolta, chiaramente le cellule CD4–CD8– αβ giocano un ruolo importante nella patogenesi di queste malattie. Una comprensione degli eventi biochimici che porta all’apoptosi spiega come mutazioni dominanti causano la malattia in molti pazienti ALPS. A livello molecolare, ora sappiamo che la preassociazione del recettore di morte Fas e il suo elevato ordine di interazioni sono essenziali per l’induzione dell’apoptosi. Anche caspasi 10, che è presente nell’uomo ma non nei topi, è un altro componente critico. Al contrario, la sua molecola correlata, caspasi-8, anche se contribuisce alla morte, esplica un ruolo più importante nell’attivazione dei linfociti attraverso il recettore per l’antigene ed altri immunorecettori attraverso i suoi effetti su NF-kB. Lo studio di altri pazienti ALPS con difetti genetici ancora non identificati e pazienti con difetti di altre vie della morte cellulare programmata possono provare di essere ugualmente illuminanti per capire i puntelli molecolari di questo processo di base nell’uomo.
(Tratto da Nicolas Bidere, Helen C. Su, Michael J. Lenardo: “Genetic disorders of programmed cell Death in the immune system”, Annu Rev Immunol 2006; 24:321-352, by National Institutes of Health Library)




Leave a comment